IPTG (изопропил-β-D-тиогалактозид) е аналог на β-галактозидазния субстрат, който е силно индуцируем.При индуцирането на IPTG, индукторът може да образува комплекс с репресорния протеин, така че конформацията на репресорния протеин да се промени, така че да не може да се комбинира с целевия ген и целевият ген да се експресира ефективно.И така, как трябва да се определи концентрацията на IPTG по време на експеримента?Колкото по-голямо ли е, толкова по-добре?
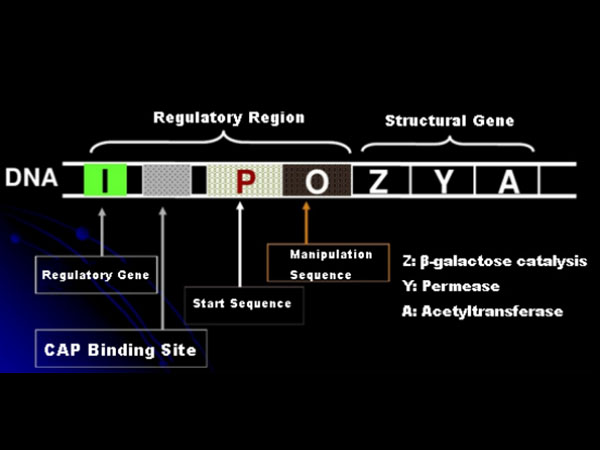
Първо, нека разберем принципа на индукция на IPTG: лактозният оперон (елемент) на Е. coli съдържа три структурни гена, Z, Y и A, които кодират съответно β-галактозидаза, пермеаза и ацетилтрансфераза.lacZ хидролизира лактозата в глюкоза и галактоза или в ало-лактоза;lacY позволява на лактозата в околната среда да премине през клетъчната мембрана и да навлезе в клетката;lacA прехвърля ацетиловата група от ацетил-CoA към β-галактозид, което включва премахване на токсичния ефект.Освен това има работна последователност O, начална последователност P и регулаторен ген I. Генният код на I е репресорен протеин, който може да се свърже към позицията O на операторната последователност, така че оперонът (мета) да бъде потиснат и изключен.Има също място на свързване за катаболен генен активатор протеин-CAP свързващо място нагоре по веригата на иницииращата последователност Р. Р последователността, О последователността и CAP свързващото място заедно съставляват регулаторната област на lac оперона.Кодиращите гени на трите ензима се регулират от една и съща регулаторна област, за да се постигне координирана експресия на генни продукти.
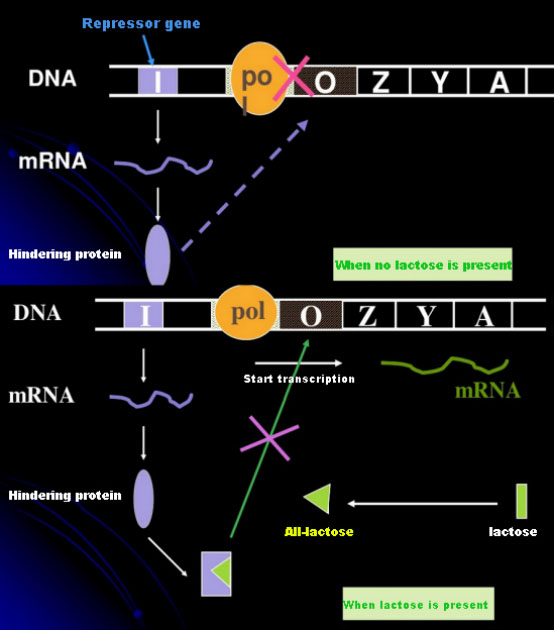
При липса на лактоза, lac оперонът (мета) е в състояние на репресия.По това време lac репресорът, експресиран от I последователността под контрола на PI промоторната последователност, се свързва с О последователността, което предотвратява свързването на РНК полимераза с Р последователността и инхибира инициирането на транскрипция;когато е налице лактоза, лактозата (мета) може да бъде индуцирана. В тази оперонна (мета) система истинският индуктор не е самата лактоза.Лактозата навлиза в клетката и се катализира от β-галактозидаза, за да се превърне в алолактоза.Последният, като индукторна молекула, се свързва с репресорния протеин и променя конформацията на протеина, което води до дисоциация на репресорния протеин от О последователността и транскрипция.Изопропилтиогалактозидът (IPTG) има същия ефект като алолактозата.Той е много мощен индуктор, който не се метаболизира от бактерии и е много стабилен, така че се използва широко в лабораториите.
Как да определите оптималната концентрация на IPTG?Вземете E. coli като пример.
Генетично модифицираният щам E. coli BL21, съдържащ положителния рекомбинантен pGEX (CGRP/msCT), се инокулира в LB течна среда, съдържаща 50 μg·mL-1 Amp, и се култивира една нощ при 37°C.Горната култура беше инокулирана в 10 бутилки от 50 mL прясна LB течна среда, съдържаща 50 μg·mL-1 Amp в съотношение 1:100 за култура на разширяване, и когато стойността на OD600 беше 0,6~0,8, IPTG беше добавен към крайната концентрация.Това е 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.След индукция при същата температура и същото време, 1 mL от бактериалния разтвор беше взет от него и бактериалните клетки бяха събрани чрез центрофугиране и подложени на SDS-PAGE, за да се анализира влиянието на различни концентрации на IPTG върху протеиновата експресия и след това изберете концентрацията на IPTG с най-голяма протеинова експресия.
След експерименти ще се установи, че концентрацията на IPTG не е възможно най-голяма.Това е така, защото IPTG има известна токсичност за бактериите.Превишаването на концентрацията също ще убие клетката;и най-общо казано, ние се надяваме, че колкото повече разтворим протеин се експресира в клетката, толкова по-добре, но в много случаи, когато концентрацията на IPTG е твърде висока, ще се образува голямо количество включване.Тяло, но количеството на разтворимия протеин намаля.Следователно най-подходящата концентрация на IPTG често не е колкото по-голяма, толкова по-добра, а колкото по-ниска е концентрацията.
Целта на индукцията и култивирането на генетично модифицирани щамове е да се увеличи добивът на целевия протеин и да се намалят разходите.Експресията на целевия ген не се влияе само от собствените фактори на щама и експресионния плазмид, но и от други външни условия, като концентрацията на индуктора, температурата на индукция и времето на индукция.Следователно, като цяло, преди неизвестен протеин да бъде експресиран и пречистен, най-добре е да се изследва времето на индукция, температурата и концентрацията на IPTG, за да се изберат подходящите условия и да се получат най-добрите експериментални резултати.
Време на публикуване: 31 декември 2021 г

